Types de corrosion
Trouver des matériaux adaptés nécessite de se pencher sur la source du problème.
> Visualiser et télécharger une version imprimable du Guide de Sélection des Matériaux

Corrosion généralisée (uniforme)
La corrosion généralisée, ou uniforme, est la plus facile à reconnaître. Découvrez comment la repérer.

Corrosion par piqûres localisée
Découvrez comment apparaissent des piqûres à la surface d’un matériau.

Corrosion caverneuse localisée
Découvrez comment la corrosion peut se former dans les anfractuosités et les espaces restreints d’un système fluide.
Corrosion sous contrainte
Découvrez comment la corrosion sous contrainte peut aboutir à une défaillance d’un composant.

Corrosion sous contrainte due aux gaz sulfureux
Les gaz sulfureux peuvent entraîner une corrosion sous contrainte due aux ions sulfure. Découvrez comment se forme ce type de corrosion.

Fragilisation par l’hydrogène
L’hydrogène a la capacité de diffuser dans les métaux, ce qui tend à fragiliser ces derniers. Choisir des matériaux résistants peut aider à remédier au problème.
Corrosion généralisée (uniforme)
Ce type de corrosion, qui est le plus connu, est également le plus facile à repérer et à prévoir. Il est peu courant – mais pas impossible – que la corrosion généralisée entraîne des défaillances catastrophiques. Pour cette raison, la corrosion généralisée est souvent davantage perçue comme une pollution visuelle que comme un problème grave. La corrosion généralisée attaque une surface métallique d’une manière relativement uniforme. La diminution progressive de l'épaisseur de paroi d'un composant doit être prise en compte dans le calcul des pressions nominales.
Comment se forme-t-elle ?
Dans un milieu marin ou tout autre environnement corrosif, la surface d’un composant fabriqué en acier au carbone ou dans un acier faiblement allié commence à se dégrader. Il se forme alors une écaille d’oxyde de fer qui va s’épaissir jusqu’à ce qu’elle se détache, entraînant la formation d’une nouvelle écaille.
On peut la mesurer de la manière suivante :
- En mesurant la perte d’épaisseur du matériau en un an. Par exemple, un acier au carbone non protégé peut se dégrader à raison d’un millimètre par an dans un environnement marin.
- En mesurant la perte de masse – généralement en milligrammes par centimètre carré de matériau exposé par jour – d’un alliage en contact avec un fluide corrosif.
Solutions possibles
316/316L Stainless Steel; Alliages 6-moly ; Alliage 2507; Alliage 825; Alliage 625; Alliage C-276; Alliage 400
Corrosion localisée par piqûres dans les fluides contenant des ions chlorures
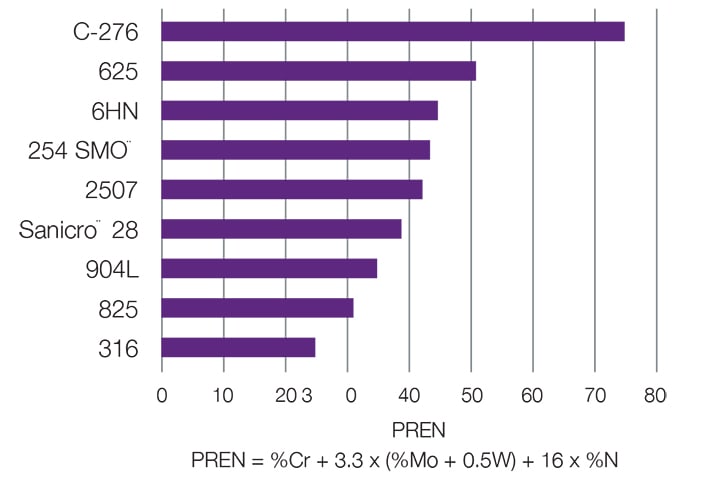
La corrosion par piqûres engendre la formation de petites cavités à la surface d’un matériau. Ces piqûres, bien que généralement décelables en procédant à un examen visuel approfondi, peuvent devenir suffisamment profondes pour perforer la paroi d’un tube. La corrosion par piqûres s’observe le plus souvent à des températures élevées dans des milieux à forte teneur en ions chlorure.
Comment se forme-t-elle ?
Lorsque la couche protectrice d’oxyde (ou couche d’oxyde inerte) présente sur la surface du métal se dégrade, celui-ci peut alors céder des électrons. Le fer de l’alliage se dissout au niveau du fond de la cavité (réaction anodique). Les ions fer se diffusent ensuite vers le haut de la cavité où ils forment de la rouille par oxydation. La solution de chlorure de fer voit sa concentration augmenter et gagne en acidité au fur et à mesure que la cavité se creuse. Il en résulte une accélération du phénomène qui aboutit à la perforation de la paroi du tube et à l’apparition de fuites.
Le meilleur moyen pour éviter la corrosion par piqûres consiste à choir un alliage adapté. L’indice de résistance à la corrosion par piqûres (PREN), qui est calculé à partir de la composition chimique du matériau, permet de comparer les différents métaux et alliages. Le PREN augmente lorsque les teneurs en chrome, molybdène et azote sont plus élevées.
Solutions possibles
Alliages 6-moly; Alliage 2507; Alliage 825; Alliage 625; Alliage C-276 ; Alliage 400
Corrosion caverneuse localisée dans les fluides contenant des ions chlorures
Dans un système fluide, des anfractuosités sont généralement présentes entre les tubes et les supports ou les colliers qui les soutiennent, entre deux tronçons de tube adjacents ou sous la boue ou les dépôts qui ont pu s’accumuler sur des surfaces. Il est pratiquement impossible de l’éviter, mais lorsque ces anfractuosités sont de petite taille, le risque de corrosion devient très important.
Comment se forme-t-elle ?
Comme la corrosion par piqûres, la corrosion caverneuse commence par une dégradation de la couche d’oxyde inerte qui protège le métal. Cette dégradation entraîne la formation de petites cavités. Les cavités gagnent en largeur et en profondeur et finissent par recouvrir entièrement l’anfractuosité.
À certains endroits, cela peut aller jusqu’à perforer le tube. La corrosion caverneuse se produit à des températures beaucoup plus basses que la corrosion par piqûres.
Solutions possibles
Alliages 6-moly; Alliage 2507; Alliage 825; Alliage 625; Alliage C-276; Alliage 400
L’importance des matériaux :
Lorsque de l’eau de mer se diffuse dans une fissure étroite, elle dissout quelques ions Fe++ qui peinent à s’en extraire rapidement. Les ions chlorure (Cl-) de charge négative, présents dans l’eau salée, sont attirés par les ions Fe++ chargés positivement et commencent à diffuser dans la fissure. Comme la concentration en ions chlorure augmente, la solution dans la fissure devient plus corrosive, ce qui accroît la dissolution des ions fer qui vont à leur tour attirer d’autres ions chlorure dans la fissure. Au bout du compte, la solution dans la fissure se transforme en une solution acide et fortement concentrée en ions chlorure, c’est-à-dire en une solution très corrosive.
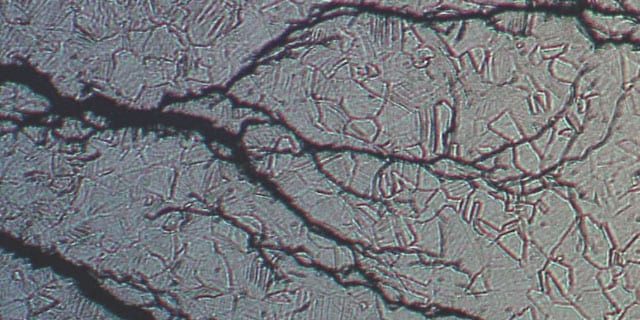
Corrosion sous contrainte dans les fluides contenant des ions chlorures
La corrosion sous contrainte (SCC) est dangereuse, car elle peut entraîner la destruction d’un composant à des niveaux de contraintes très inférieurs à la limite d’élasticité d’un alliage. En présence d’ions chlorure, les aciers inoxydables austénitiques sont sujets à ce type de corrosion. Les ions réagissent avec le matériau au fond d’une fissure – là où les contraintes de traction sont les plus fortes – ce qui favorise l’élargissement la fissure. Une fois amorcée, la corrosion sous contrainte peut s’avérer difficile à déceler : une défaillance définitive du composant concerné peut alors survenir soudainement.
Comment se forme-t-elle ?
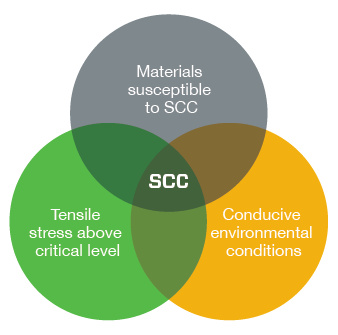
Pour que le phénomène se produise, trois conditions doivent être remplies simultanément :
- Le métal doit être sensible à la corrosion sous contrainte
- Des conditions ambiantes (température, type de fluide) propices à ce type de corrosion doivent être réunies
- Les contraintes de traction (appliquées + résiduelles) doivent être supérieures au niveau critique
Solutions possibles
Alliages 6-moly; Alliage 2507; Alliage 825; Alliage 625; Alliage C-276; Alliage 400

Corrosion sous contrainte en présence d’une pression partielle de sulfure d'hydrogène (H2S) élevée
La corrosion sous contrainte due aux gaz sulfureux a pour effet de dégrader un métal en contact avec de l’hydrogène sulfuré (H2S) dans une atmosphère humide. En présence d’eau, l’hydrogène sulfuré (ou sulfure d’hydrogène - H2S) devient extrêmement corrosif. Cette situation peut conduire à une fragilisation du matériau et aboutir à une fissuration sous l’action conjuguée de contraintes de traction et de la corrosion.
Comment se forme-t-elle ?
Le risque de corrosion sous contrainte due aux gaz sulfureux augmente avec les facteurs suivants :
- Le métal doit être sensible à la corrosion sous contrainte
- Le milieu doit être suffisamment acide (riche en sulfure d’hydrogène H2S)
- Les contraintes de traction (appliquées + résiduelles) doivent être supérieures au niveau critique
Le risque est plus grand – par rapport à des matériaux moins sujets à ce type de corrosion – dans les situations suivantes :
- Dureté du matériau/résistance à la traction élevée
- Forte concentration en ions hydrogène (pH faible)
- Pression partielle du sulfure d’hydrogène élevée
- Contrainte de traction totale (appliquée + résiduelle) élevée
- Période d’exposition prolongée
Le risque de corrosion sous contrainte due aux gaz sulfureux augmente à des températures plus basses lorsque la ductilité des matériaux tend à diminuer.
Solutions possibles
Alliages 6-moly; Alliage 2507; Alliage 825; Alliage 625; Alliage C-276; Alliage 400
L’importance des matériaux :
La norme NACE MR0175/ISO 15156 précise les matériaux à utiliser dans des environnements contenant de l’hydrogène sulfuré. Pour plus d’informations sur le choix des composants pour systèmes fluides destinés à l’exploitation de gisements de pétrole riche en soufre, reportez-vous à l’article intitulé Selecting fluid system components for use in sour oilfields.

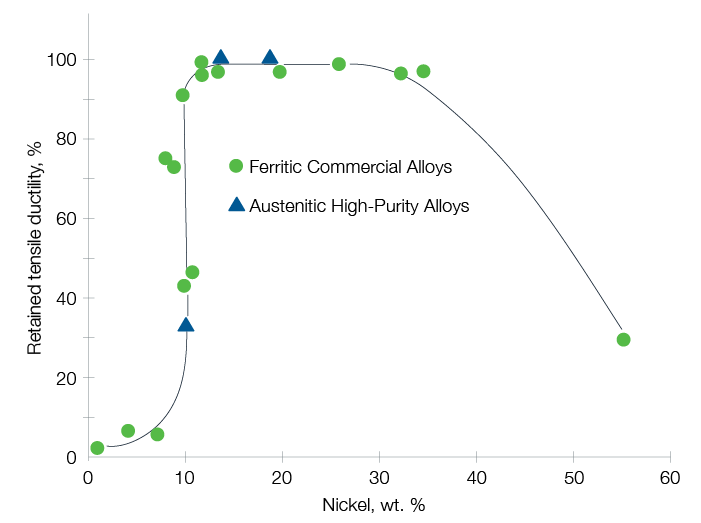
Fragilisation par l’hydrogène
Les atomes d’hydrogène ont la capacité de diffuser dans les métaux, ce qui tend à fragiliser ces derniers. Tous les matériaux sujets à cette fragilisation par l’hydrogène sont également très sensibles à la corrosion sous contrainte.
Comment se forme-t-elle ?
Une fissuration par l’hydrogène peut se produire si le métal est soumis à des contraintes de traction statiques ou cycliques. L’hydrogène peut modifier les propriétés mécaniques et le comportement du métal, notamment de la manière suivante :
- Diminution de la ductilité (allongement et réduction de la section)
- Diminution de la résistance aux chocs et de la ténacité
- Augmentation de la tenue à la fatigue
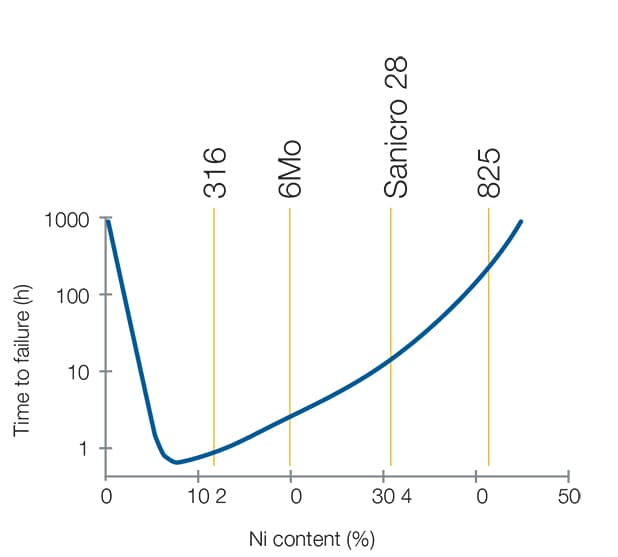
Cette fragilisation peut être évitée en sélectionnant un matériau résistant à l'hydrogène – un alliage austénitique à teneur en nickel comprise entre 10 et 30 % par exemple.
Source : G.R. Caskey, Hydrogen Compatibility Handbook for Stainless Steels (1983)
Solutions possibles
Corrosion intercristalline
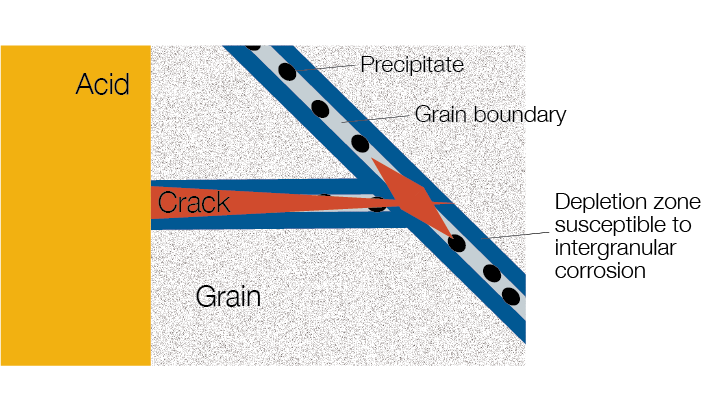
Pour comprendre la corrosion intercristalline (IGC), imaginez que tous les métaux sont constitués de « grains ». À l’intérieur de chaque grain, les atomes sont disposés régulièrement de manière à former un réseau cristallin tridimensionnel. La corrosion intercristalline attaque le matériau au niveau des limites intergranulaires (là où s’assemblent les grains qui constituent le métal).
Comment se forme-t-elle ?
Au cours d’une opération de soudage, d’un traitement thermique ou d’une exposition à des températures élevées, des carbures peuvent commencer à se former au niveau des limites intergranulaires. Avec le temps, la taille de ces précipités de carbure peut augmenter. Cette formation de carbure nuit à l’uniformité de la répartition des éléments au sein du métal, dans la mesure où la précipitation capte des éléments importants comme le chrome dans le matériau au voisinage des limites intergranulaires. Lorsque des fluides corrosifs (comme les acides) attaquent les zones où le chrome a disparu, des fissures intergranulaires peuvent se former. Ces fissures peuvent ensuite se propager dans l’ensemble du matériau sans être détectées, ce qui fait de corrosion intercristalline une forme dangereuse de corrosion.
Solutions possibles
Corrosion galvanique en présence d'un électrolyte
La corrosion galvanique se produit quand deux matériaux aux potentiels d’électrode différents entrent en contact l’un avec l’autre en présence d’un électrolyte.
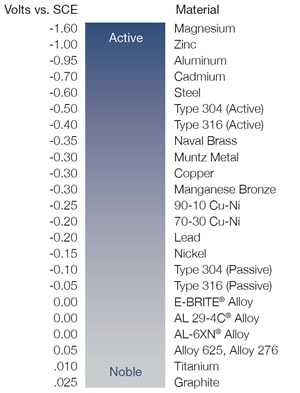
La très fine couche inerte présente sur un acier inoxydable est constituée d’un oxyde riche en chrome qui se forme automatiquement dans l'air ambiant et protège le matériau contre la corrosion. Cette couche inerte rend un matériau plus noble et moins sensible à la corrosion. La compatibilité des métaux peut être déterminée par leur potentiel anodique, c’est-à-dire la différence de potentiel de chaque métal mesurée dans l’eau de mer par rapport à une électrode normale.
Comment se forme-t-elle ?
Lorsque la différence de potentiel entre deux métaux différents en présence d’un électrolyte est trop grande, la couche inerte qui recouvre le matériau commence à se décomposer.
Solutions possibles
Pour éviter la corrosion galvanique, choisissez des matériaux dont la différence de potentiel ne dépasse pas 0,2 V. Par exemple, si l’on associe un raccord en acier inoxydable 316 (-0,05 V) avec des tubes en alliage 6-moly (0,00 V), la différence de potentiel entre les deux alliages sera de 0,05 V. Cette différence de potentiel est nettement inférieure à 0,2 V, d’où un faible risque de corrosion galvanique.
Pour plus d'informations, consultez ces autres documents de référence produits par Swagelok.
> Afficher et télécharger une version imprimable du guide de sélection des matériaux
1 Source : Science Direct, Volume 1, Nº 3, S.M.R. Ziaei, A.H. Kokabi, M. Nasr-Esehani, Sulfide Stress Corrosion Cracking and Hydrogen Induced Cracking of A216-WCC Wellhead Flow Control Valve Body case study, pages 223 et 224, juillet 2013. Reproduit avec l'autorisation d’Elsevier.
2 Photo d’un matériau fragilisé par l’hydrogène publiée avec l’aimable autorisation de Salim Brahimi, Ibeca Technologies Corp.