Cómo Gestionar la Vaporización en los Sistemas de Toma de Muestra

Cómo gestionar la Vaporización en Sistemas de Toma de Muestra
12 de marzo de 2019 | Jon Kestner
Vaporizar una muestra no es fácil, y no siempre es posible. Sin embargo, si el analizador de su sistema analítico de toma de muestras requiere gases pero las muestras son líquidas, la única opción es convertir el líquido en un gas. A este proceso se le llama vaporización o vaporización flash. La finalidad es convertir instantáneamente una muestra totalmente líquida en vapor sin cambiar su composición.
Si va a proceder con ello, es importante entender la diferencia entre evaporación y vaporización. La evaporación ocurre gradualmente con un aumento de la temperatura. La vaporización se produce instantáneamente con una pérdida de presión.
No se puede vaporizar una muestra incrementando la temperatura. El calor provoca la evaporación, y añadir calor únicamente hace que la evaporación sea más rápida. En una muestra de una mezcla, la evaporación permitirá a algunos componentes evaporarse antes que otros causando el fraccionamiento. La vaporización hecha correctamente asegura que todos los componentes se vaporizan al mismo tiempo, manteniendo la composición de la muestra.
En la vaporización se pueden producir errores. En lugar de pasar la muestra instantáneamente a vapor, inintencionadamente se puede provocar una combinación de vaporización y evaporación, lo cual produce fraccionamiento. Si una muestra mixta se fracciona no podrá analizarse.
La hipótesis general que se da con el fraccionamiento es que las moléculas más ligeras se evaporan antes y se dirigen hacia el analizador, mientras que las moléculas más pesadas permanecen en fase líquida. Y aunque más tarde durante el proceso la muestra fraccionada sea toda gas, la mezcla no será de las mismas proporciones moleculares que lo era antes del fraccionamiento. Por tanto no va a representar con exactitud el producto tomado de la línea de proceso. Ajustar las variables de proceso--temperatura, presión y caudal – puede ayudar a asegurar una correcta vaporización y un resultado analítico preciso.
Entender la Vaporización
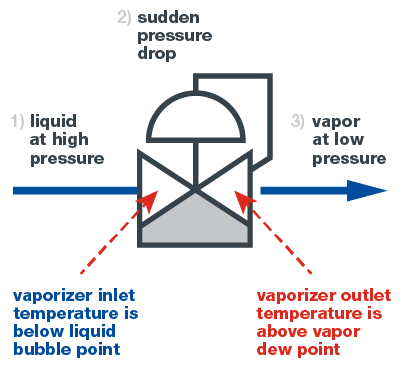
Para vaporizar una muestra, se suele utilizar un regulador vaporizador, también llamado simplemente un vaporizador. Un vaporizador es un regulador reductor de presión con la capacidad de transferir calor a la muestra en el punto exacto. Tal y como muestra el gráfico siguiente, la vaporización es un proceso de tres etapas. En la primera, la muestra entra en el vaporizador como un líquido. En este punto, el líquido no debe hervir.
En la segunda, el líquido pasa a través de la cavidad reguladora del vaporizador, lo cual produce una severa y repentina pérdida de carga que vaporiza el líquido. Al mismo tiempo se aplica calor, permitiendo al líquido vaporizado permanecer como un vapor.
En la tercera, la muestra, ahora un gas, sale del regulador vaporizador y llega al analizador para ser leída. Debido a la transición inmediata a la fase vapor, la composición del gas no cambia en relación a la del líquido, asegurando una lectura exacta.
En este delicado proceso hay muchas variables o aspectos de los que depende el éxito o el fallo. Para el propósito de este análisis, nos centraremos en dos grupos de variables.
El primer grupo de variables se refiere a la composición de la muestra. En función de su composición, la muestra empezará a hervir y acabará vaporizada a diferentes presiones y temperaturas. Tendremos que saber cuáles de esas presiones y temperaturas son las que aseguran el éxito del proceso.
El segundo grupo de variables concierne a los ajustes controlables del sistema de toma de muestras: presión, temperatura y caudal. La presión y la temperatura se controlan en el vaporizador, mientras que el caudal se controla aguas abajo en un rotámetro (medidor de caudal de área variable) y una válvula de aguja. Estas variables se ajustan sobre lo que sabemos del primer grupo de variables. Una correcta vaporización necesita un equilibrio delicado de cada variable. Aún enfocando la vaporización de una forma sistemática como ésta, el proceso necesitará algunas pruebas.
Conocer la Muestra
La mejor forma de entender el primer conjunto de variables es mediante un diagrama de fases. Un diagrama de fases es un gráfico sobre presión y temperatura que muestra en cualquier par de estas condiciones si una substancia será vapor, líquido o sólido. Las líneas indican la sucesión entre dos fases.
El gráfico de abajo representa un diagrama de fase de pentano al 20 por ciento de hexano. Cuando la muestra está por encima del punto de ebullición (línea azul) es toda líquida. La muestra debe ser totalmente líquida cuando entra en el vaporizador. Cuando la mezcla está por debajo del punto de rocío (línea dorada), es toda vapor. La muestra debe ser toda vapor cuando sale del vaporizador.
Diagrama de fase mostrando pentano al 20 por ciento de hexano con ajustes de temperatura.
Entre el punto de ebullición y el punto de rocío está el intervalo de ebullición o “zona de exclusión” de la muestra. Aquí, la mezcla está en dos fases-- parte líquida y parte vapor. Una vez la muestra cae en este rango, está fraccionada y ya no será útil para el análisis.
En el caso de las muestras puras o prácticamente puras, el intervalo de ebullición es pequeño o inexistente. Las líneas del punto de ebullición y del punto de rocío están prácticamente superpuestas. Las muestras puras o casi puras se convertirán en vapor con la misma composición, tanto si se evaporan como si se vaporizan. Algunas muestras industriales se acercan a este nivel de pureza y se convierten con facilidad.
Por otro lado, algunas muestras tienen un intervalo de ebullición tan amplio que no pueden ser vaporizadas satisfactoriamente. No hay forma de pasar desde el lado líquido al lado vapor del intervalo de ebullición. Las variables – temperatura, caudal y presión – no se pueden alterar para evitar el fraccionamiento.
La mayoría de las muestras están entre estos dos extremos. Por ejemplo, en el diagrama de fase de muestra, la franja entre los puntos de ebullición y rocío es lo suficientemente estrecha como para que con los ajustes adecuados, la muestra pueda pasar eficazmente del lado líquido al lado vapor del intervalo de ebullición. Al mismo tiempo, la franja es lo suficientemente ancha como para poder modificar cuidadosamente las variables y evitar tener la muestra en el intervalo de ebullición.
Ajustar la Temperatura, la Presión y el Caudal
La vaporización es el equilibrio entre las variables. El siguiente es un proceso de cuatro etapas para ajustar las variables de temperatura, presión y caudal.
- Determinar la presión de entrada en el vaporizador. Esta presión, que es fija, es la presión de proceso, la que le llega al vaporizador ubicado cerca de la válvula de entrada La presión alta es mejor porque permite mantener alta la temperatura del vaporizador sin alcanzar el punto de ebullición del líquido que llega.
- Ajustar la temperatura de entrada. TLa temperatura se ajusta con dos objetivos. El primero, la temperatura debe ser suficientemente baja como para que cuando la muestra entre en el vaporizador sea totalmente líquida y no entre en ebullición. En el diagrama de fase del pentano con un 20 por ciento de hexano, el punto de ebullición a 4 bar es de 88˚C. Para dar un margen de error y mantener el estado líquido, elijamos 80˚C.
El segundo objetivo es que la temperatura sea suficientemente alta para ayudar a la vaporización de la muestra. Cuando se vaporiza la muestra, la temperatura cae de acuerdo a las leyes de la conservación de la energía. La temperatura inicial de la muestra debe ser suficientemente alta como para que tras la pérdida de carga ésta no vaya al intervalo de ebullición. - Ajustar la presión de salida en el vaporizador. El objetivo es crear una caída de presión por debajo de la línea dorada que indica el punto de rocío. En el diagrama de fase del ejemplo, la presión de salida está a ajustada a 1,5 bar. Si la presión de salida fuese ligeramente superior, la muestra no se vaporizaría por completo y se fraccionaría.
- Ajustar el caudal. El caudal se ajusta aguas abajo en una válvula y un rotámetro, no en el vaporizador. En un sistema de toma de muestras es deseable un alto caudal de vapor porque transporta la muestra hacia el analizador más rápido. Pero un alto caudal puede ser problemático también, porque hace falta más calor para vaporizar la muestra. O lo que es lo mismo, el alto caudal provoca una mayor bajada de temperatura en el momento de la vaporización. En el diagrama de fase del ejemplo, la línea púrpura muestra la bajada de temperatura. Según aumenta el caudal la línea púrpura se inclina considerablemente a la izquierda.
Otra variable que influye en la caída de temperatura es la capacidad de transferir calor del vaporizador. La construcción de algunos vaporizadores permite una transferencia de calor más eficiente a la muestra. Cuando una muestra líquida se convierte en vapor y su temperatura baja, se equilibra aprovechando el calor del acero inoxidable a su alrededor. La cuestión crítica es la eficiencia con la que el vaporizador puede volver a calentar y mantener caliente la muestra. Cuanto más calor pueda utilizar la muestra menor es la bajada de temperatura durante la vaporización.
Hasta es posible que el vaporizador esté caliente al tacto en el exterior pero frío en el núcleo. Eso se da porque la muestra vaporizada atrae mucha cantidad de calor y el vaporizador no puede transferir suficiente calor para continuar. La mejor solución es reducir el caudal.
La vaporización implica algún tipo de aproximación. Los Ingenieros de campo de Swagelok pueden ayudar a su equipo a determinar los vaporizadores adecuados para su sistema de toma de muestras específico. Como norma general, mantenga el caudal lo más bajo posible sin producir un retardo inaceptable en el trayecto de la muestra al analizador. Es mejor empezar con un bajo caudal y ensayar incrementos que empezar con una tasa de caudal mayor.
Localización y solución de problemas
Los diagramas de fase le permitirán aproximarse a los ajustes de temperatura, presión y caudal, pero será necesario solucionar algunos problemas. Un indicativo seguro de un problema es la poca consistencia de los resultados de analizador. A continuación mostramos dos posibilidades de fraccionamiento en lugar de vaporización de la muestra, siendo el problema #1 el más habitual:
Problema 1: Solo se está vaporizando parte de la muestra. El líquido está pasando a través del vaporizador y situándose aguas abajo en el tubo. Finalmente se evapora, y al hacerlo, absorbe calor del tubo cercano enfriándolo al tacto o provocando la formación de escarcha o hielo. El líquido aguas abajo del vaporizador puede pasar más allá del área del éste y alcanzar otros componentes como medidores de caudal o filtros, en los que puede provocar daños considerables.
Solución: Para solucionar este problema, la mejor opción sería reducir el caudal. Otra opción sería reducir la presión de salida del vaporizador, si es posible. Una tercera opción sería incrementar el calor en el regulador, pero con el riesgo añadido de reducir la vida de servicio del vaporizador y potencialmente provocar el problema #2 (ver abajo).
Problema 2: La muestra está hirviendo en la entrada al vaporizador. Se está fraccionando antes de que pueda ser vaporizada. Un indicador de este problema es que el tubo de entrada al vaporizador presenta sacudidas, a veces violentas, y los valores de medición oscilan. Las moléculas más ligeras se evaporan y producen una gran nube de moléculas de vapor. Algunas de esas moléculas ligeras llegan al analizador, produciendo un análisis inexacto. El resto crea una "pared de vapor", que empuja al líquido en sentido inverso hacia el proceso. Una porción de esa pared de vapor se enfría y se condensa. Finalmente la muestra líquida vuelve hacia el vaporizador, donde las moléculas más ligeras se evaporan e inician el ciclo de nuevo. Ocasionalmente las moléculas más pesadas alcanzan el vaporizador y llegan al analizador produciendo un análisis completamente diferente.
Solución: Para solucionar este problema, reduzca la temperatura del vaporizador.
Conclusión
Vaporizar una muestra líquida es un reto. En muchos sistemas de toma de muestras en todo el mundo, los vaporizadores fraccionan muestras continuamente y envían muestras no representativas al analizador. Multiplique sus oportunidades de éxito haciendo un estudio sobre diagramas de fases para su particular mezcla de componentes. También puede hacerlo comprendiendo lo que ocurre en el proceso – concretamente, conociendo las variables (temperatura, presión y caudal) y su papel e influencia sobre los resultados del proceso. Con este marco en su sitio, puede conseguir los ajustes adecuados, regulándolos en base a los signos y síntomas observados.
Artículos relacionados

Intercambiadores de Calor de Vapor y Sistemas de Traceado Mejores Prácticas para Ingenieros de Diseño
Para seleccionar componentes de intercambiadores de calor y traceado para sistemas de vapor, es necesario que los ingenieros de diseño entiendan las características y requisitos operativos del sistema. Revise las mejores prácticas Swagelok para mejorar los sistemas de vapor de sus instalaciones.

10 Consejos para Mejorar los Sistemas de Muestreo
Gestionar una operación de instrumentación analítica no es nada fácil. Obtener resultados consistentes puede ser una lucha hasta para los ingenieros más experimentados. Afortunadamente, hay bastantes consejos sencillos que su equipo puede utilizar para mejorar su sistema de toma de muestras.